Chapitre 1
Pour chaque question, cochez la ou les réponse(s) exacte(s) :
-
On considère un volume de gaz V = 500 ml placé dans un ballon fermé. Le volume molaire vaut Vm = 25 L.mol-1.
002x- La quantité de matière de ce gaz vaut n = 20 mol.
- La quantité de matière de ce gaz vaut n = 20 mmol.
-
Si on augmente la température du gaz :
002x- La quantité de gaz va augmenter.
- Le volume molaire va augmenter.
-
On considère le couple Zn2+/Zn.
001x::003x- La demi-équation du couple s'écrit Zn2+ + 2 e- = Zn.
- Le métal zinc Zn est réduit en cédant des électrons.
- L'ion zinc Zn2+ est réduit en gagnant des électrons.
- L'ion zinc Zn2+ pourra réagir avec le fer III Fe3+ du couple Fe3+/Fe2+.
-
Un morceau de magnésium métallique est attaqué par une solution acide en excès. La réaction est totale. Les couples mis en jeu sont : Mg2+/Mg et H+/H2.
002x::003x- L'équation de la réaction Mg2+(aq) + H2(g) Mg(s) + 2 H+(aq)
- Cette transformation produit un gaz.
- Le morceau de magnésium va disparaître totalement.
- Il s'agit d'une réaction acido/basique.
-
Suite de l'exercice précédent. Pour récupérer le gaz formé, on utilise le montage expérimental dont le schéma est donné ci-contre.
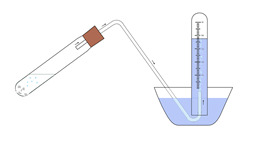 001x::002x::003x
001x::002x::003x- Le volume de gaz produit est celui mesuré dans l'éprouvette.
- Le volume molaire d'un gaz vaut environ 20 L.mol-1 à pression atmosphérique et température ambiante.
- Le principe est celui du déplacement d'eau.
-
L'ion permanganate MnO4- est un oxydant auquel est associé le réducteur Mn2+. La demi-équation du couple Fe3+/Fe2+ s'écrit Fe3+ + e- = Fe2+.
003x::004x::005x- L'ion permanganate fait partie du couple Mn2+/ MnO4-
- L'ion permanganate est un bactéricide, il peut donc désinfecter des instruments de chirurgie.
- La demi-équation est MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O.
- L'équation de la réaction entre l'ion permanganate et l'ion fer II Fe2+ s'écrit : MnO4- + 8 H+ + 5 Fe2+ = Mn2+ + 4 H2O + 5 Fe3+.
- La présence de l'ion H+ dans une demi équation, indique que le milieu doit être acide.
-
Le temps de déclenchement d'un airbag en cas de choc important sur un véhicule (après décision du calculateur) est de l'ordre de :
002x- 100 ns.
- 100 ms.
-
Le gaz permettant de gonfler l'airbag est :
003x- L'air.
- Le dioxygène.
- Le diazote.
-
L'alcooltest ou éthylotest met en évidence une alcoolémie trop importante. La réaction produit un changement de couleur, basée sur :
003x- une réaction acidobasique.
- une réaction de précipitation.
- une réaction d'oxydoréduction.