Éditions Hatier, Paris, 2023
Thème 1 : Prévenir et sécuriser
quiz
Chapitre 3
Pour chaque question, cochez la ou les réponse(s) exacte(s) :
-
On considère une liaison A—B où A et B sont des éléments chimiques ayant respectivement les électronégativités et :
002x::004x- l'électronégativité indique la charge d'un élément chimique.
- si = 1 alors A porte une charge légèrement négative et B une charge légèrement positive.
- si < 0,4 alors la liaison A—B est polaire.
- si la liaison est ionique A+ + B- alors .
-
L'eau H2O :
001x::003x::004x- est une molécule polaire.
- est un bon solvant des hydrocarbures.
- est un constituant essentiel du corps humain.
- assure une bonne solvatation des ions.
-
La conductivité :
001x::003x::004x- a pour unité le siemens par mètre.
- a pour unité le siemens S.
- est proportionnelle à la concentration en ions.
- est basée sur le passage d'un courant.
-
L'eau potable :
001x::003x- doit se conformer à de nombreuses normes microbiologiques, physicochimiques…
- est une ressource très abondante.
- contient des ions.
- provient directement des fleuves ou des lacs, avant d'être envoyée dans le réseau de distribution.
-
Soit la réaction support d'un dosage I2 + 2 S2O32- 2 I- + S4O62-, permettant le dosage d'une solution de diiode I2 placée dans un erlenmeyer par une solution d'ion thiosulfate.
001x::002x::004x- Cette équation est correctement équilibrée.
- À l'équivalence, la concentration en diiode peut être déterminée.
- Avant l'équivalence, l'espèce en excès est l'ion thiosulfate.
- À l'équivalence, les deux réactifs sont limitant et n(I2) = n(S2O32-)/2.
-
Lors d'un dosage ayant pour support cette équation Ag+ + Cl- AgCl :
003x- on suit le pH en fonction du volume de solution titrante ajouté.
- la réaction de dosage est basée sur l'oxydoréduction.
- la réaction peut être suivie avec un conductimètre.
-
Suite de l'exercice précédent. On obtient cette courbe lors du dosage :
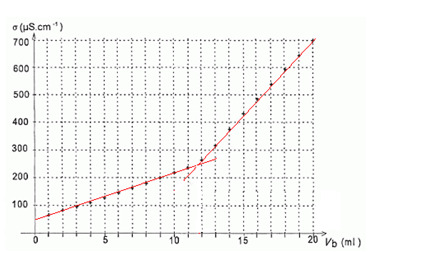 001x::002x
001x::002x- L'équivalence est repérée lors de la rupture de pente.
- Le volume à l'équivalence vaut Véq = 11,8 ml.
- Le volume à l'équivalence vaut Véq = 230 mS.m-1.
Score :
10
1.0
Bravo !
Félicitations !
Parfait !
Encore un effort
vous y êtes presque !
Avez-vous été suffisamment attentif/attentive ?
Revoyez votre leçon pour progresser.