Chapitre 8
Pour chaque question, cochez la ou les réponse(s) exacte(s) :
-
On dissout une quantité n = 0,50 mol de chlorure de magnésium dans l'eau.
001x::003x- La formule du solide est MgCl2.
- L'équation de dissolution est Mg2+ + 2 Cl- MgCl2.
- On obtient 0,50 mol d'ion magnésium et 1,0 mol d'ion chlorure.
-
On dissout une quantité m = 0,30 mol d'une espèce chimique solide de masse molaire afin d'obtenir une solution de volume total V = 200 ml.
001x::003x- Il s'agit d'une dissolution.
- La concentration massique est Cm = 1,5 g.L-1.
- La concentration molaire vaut C = 1,5 mol.L-1.
-
On dissout une masse m = 1,60 g d'une espèce chimique solide de masse molaire M = 80 g.mol-1 afin d'obtenir une solution de volume total V = 250 ml.
002x::004x- La quantité de matière introduite de cette espèce vaut 50 mol.
- La concentration massique vaut Cm = 6,4 g.L-1.
- La concentration molaire vaut C = 0,80 mol.L-1.
- Cette dissolution nécessite une fiole jaugée et une balance de précision.
-
On souhaite obtenir un volume V = 200,0 ml d'une solution diluée 10 fois à partir d'une solution mère de concentration molaire volumique Cm = 0,450 mol.L-1.
002x::004x- Le volume de solution mère à prélever est Vm = 10 ml.
- La dilution est réalisée en utilisant une pipette jaugée et une fiole jaugée.
- La solution fille est préparée en utilisant de l'eau du robinet.
- La solution fille a une concentration Cm = 0,0450 mol.L-1.
-
L'absorbance A dans le domaine visible :
001x::002x::003x- s'exprime sans unité.
- est nulle pour une solution incolore.
- dépend de la substance dissoute, de sa concentration et de la longueur d'onde choisie.
-
On souhaite déterminer la teneur en diiode d'une solution aqueuse à l'aide d'un dosage spectrophotométrique par étalonnage. Pour cela, on procède à l'étalonnage d'une gamme de solutions de diiode de concentrations C(I2) en quantité de matière de I2, connues. La mesure de l'absorbance A de chaque solution, réalisée avec un spectrophotomètre visible, permet d'obtenir la courbe d'étalonnage, qui représente l'absorbance A des solutions en fonction de leur concentration en quantité de matière de I2, C(I2).
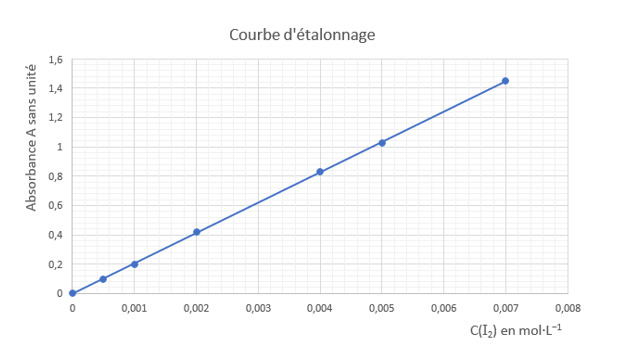 001x::003x
001x::003x- L'absorbance A de la solution de diiode est proportionnelle à la concentration C(I2) en quantité de matière de diiode. Sans modifier les réglages du spectrophotomètre, on mesure l'absorbance de la solution ainsi diluée. On trouve Asolution diluée = 0,90.
- La solution inconnue a une concentration C(I2) = 4,5 mol.L-1.
- La spectroscopie utilise des ondes électromagnétiques du domaine visible.